اسید فسفریک
تولید اسید فسفریک یکی از چالش برانگیزترین صنایع مخلوط است. فرایند تولید شامل یک سری مخازن واکنشی است که در آن فسفات با اسید سولفوریک واکنش داده می شود. همزن ها و قطعات مرطوب در معرض مایعات و بخار خوردگی قرار می گیرند که تجهیزات چرخش را از بین می برند. سنگ فسفری بلور می شود و در ناحیه های مرده در هر حلقه به دام می افتد و باعث می شود که ذرات به هم متصل شوند و هسته ای از سنگ های غیر واکنش را ترک کنند که باعث کاهش تولید می شود و تمایل به پیوستن به دیواره های کشتی و سطوح پروانه می باشد. انباشته شدن اسید فسفریک می تواند به اندازه کافی بزرگ برای شکستن و از بین بردن پروانه ها، شفت ها یا درایو های مخلوط با بارهای ناگهانی شوک شود. نتیجه یک فرآیند مخلوط کردن ناکارآمد با بازده مواد نامطلوب و خرابی تجهیزات مزمن است.
در تولید فسفریک اسید با استفاده از فرآیند پذیرفته شده صنعت، ذرات فسفات ذرات ریز به دلیل میزان مخلوط در مخزن توزیع می شوند. فرایندهای مخلوط متعارف به مناطق مرده اجازه می دهد تا دیواره های حلقوی و آگلومره های کریستال گچ را تشکیل دهند و ذرات بزرگتر را با سنگ های غیر واکنشی در هسته خود تشکیل دهند. ذرات بزرگ معمولا دیواره های مخزن را پوشانده اند، جایی که قطعه ها می توانند سقوط کنند و شکست بخورند یا باعث ایجاد شرایط کار خطرناک در حین تعمیر و نگهداری شوند. همان طور که گچ بر روی دیوار اثر می گذارد، خروجی کاهش می یابد و به سودآوری برسد.
توانایی بهبود مخلوط کردن مخزن در اوایل فرایند برای بهبود قابلیت اطمینان مکانیکی مخلوط های راکتور بسیار مهم است. عملکرد پروانه های طراحی شده ما، معیارهای طراحی مکانیکی و طرح های اتصال سفت و سخت همچنان به آزمون زمان برسند. موفقیت ما حادثه نیست. عملکرد فرآیند ما باعث ریشه یابی ریشه ها می شود که منجر به شکست می شود.
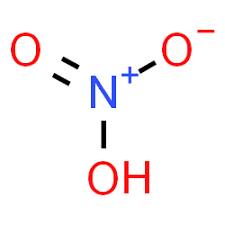
از اسید نیتریک اطلاعاتی در مورد خود ماده در اختیار شما قرار می دهیم. از خصوصیات اسید نیتریک که در دمای -41.6 درجه سانتی گراد ذوب می شود. بعد از این عمل ذوب مایع بی رنگی بدست می آید. رنگ آن از زرد تا قرمز ( قهوه ای) تغییر می کند. این باعث می شود که تحت فشار می شود. از دیگر ویژگی ها می توان گفت که با قابل احتراق است و در این زمانآزئوتروپی را بدست ما می دهد. امروزه اطلاع از قیمت و خرید و فروش اسید نیتریک در اینترنت فراهم شده است.
دو روش برای خالص سازی اسید نیتریک وجود دارد:
- اضافه کردن نیترات منیزیم خشک به اسید نیتریک
- اضافه کردن اسید سولفوریک به اسید نیتریک
به یکی دیگر از اسید ها اشاره می کنیم و آن سیلیکاژل آبی می باشد. جالب است بدانید این اسید در پرتقال و لیمو ترش وجود دارد. اسید سیتریک یا جوهر لیمو از جمله اسید های آلی هستند. اسید سیتریک به صورت کریستال های پودر شده است و بسته بندی می شود.
برای آشنایی با یک اسید دیگر مثل آب اکسیژنه ترک باید گفت که از آن به عنوان گنا و یا یک عامل مواد نگهدارنده در موارد مختلف مثل کوزه گری و یا شیشه انجام می گیرد. از اسید بوریک در منسوجات و یا بافت های پارچه مورد استفاده قرار می گیرد. اسید بوریک در حرارت و یا دمای بالا تغییر شکل می دهد.
منبع: لینک منبع
آب ژاول را از دمیدن گاز کلر درمحلول سدیم هیدروکسید تهیه می کنند. از جمله تستهایی که روی آب ژاول (هیپوکلریت سدیم) انجام میشود تعیین مقدار کلر آزاد و تعیین مقدار NaOH است. آب ژاول محلولی ناپایدار است ودر اثر حرارت و نور به تدریج خاصیت خود را از دست میدهد. رايجترين ماده اي که از آن ، به عنوان سفيد کننده استفاده می گردد، آب ژاول است. ماده اصلي و موثر در آب ژاول ، هيپوکلريت سديم (NaOCl) است. هيپوکلريت سديم ،ترکيبي یسار بسیار قوي است که درصد خيلي کمي از آن (5 درصد) را در آب حل ميکنند و با نامهاي متفاوت و به عنوان سفيد کننده به بازار عرضه ميکنند. فرمول آی ژاول به صورت NaOCl ----> NaCl + O2 می باشد. بنابراين سفيد کنندهها و آب ژاول ، همان محلول 7 درصد هيپوکلريت سديم هستند.
مزيت آب ژاول (اکسید کلرید سدیم) اين است که خاصيت ضدعفوني کننده نيز دارد، زيرا يک سفيدکننده کلردار است. افزودنمقدار کمي پربورات به آب ژاول ، قدرت سفيدکنندگي آن را افزايش ميدهد. البته بايد توجه داشت که (آنتی فرمین) محلول هيپوکلريت سديم ، ناپايدار است و در مجاورت نور و گرما ، يون -OCl تجزيه شده، اکسيژن آزاد ميکند و در نتيجه از شدت عمل آن کاسته ميشود. لذا بايد آن را در ظروف مات و نيز آنتی فرمین دور از گرما نگهداري کرد. همچنين بهتر است محلولهاي تازه استفاده شود، زيرا بهر حال در اثر ماندن بسادگي تجزيه ميشود.
فرمول شیمیایی مایع سفید کننده یا همان آب ژاول که برای سفید کردن پارچه و شستشوی دیواره های حمام، توالت و بکار میرود، NaOH+NaCl+H2O است و از ترکیب کردن گاز کلر با سود سوزآور در غلظت های 5 الی 10 درصد کلر فعال به بازار عرضه می گردد.
منبع: لینک منبع
اسید سیتریک یک اسید ضعیف آلی است که در مرکبات یافت می شود. اسید سیتریک یک نگهدارنده طبیعی است و همچنین برای افزودن طعم اسیدی (ترش) به غذاها و نوشیدنی های غیر الکلی استفاده می شود. در بیوشیمی، مهم است به عنوان یک واسطه در چرخه اسید سیتریک و در نتیجه اسید سیتریک، متابولیسم تقریبا همه چیزهای زندگی رخ می دهد. اسید سیتریک همچنین به عنوان عامل تمیزکننده محیط زیست عمل می کند و به عنوان آنتی اکسیدان عمل می کند.اسید سیتریک در انواع میوه ها و سبزیجات وجود دارد، اما بیشتر در لیمو و لیمو متمرکز شده است، در حالی که می تواند تا 8 درصد وزن خشک میوه را تشکیل دهد.
اسید سیتریک یک متابولیت طبیعی و یک واسطه در متابولیسم اکسیداتیو سلولی است. اسید سیتریک که در میتوکندری پس از تراکم استات با اگزالاسیتات تشکیل شده است. سپس اسید شش کربن به طور متوالی به یک سری اسیدهای چهار کربن تخریب می شود که به طور موثر اکسیداسیون استات در سلول انجام می شود. اطلاع از نحوه خرید اسید سیتریک و فروش اسد سیتریک به راحتی امکان پذیر است.بنابراین، اسید سیتریک به دی اکسید کربن و آب بدن متابولیزه می شود و تنها اثر گذرا بر وضعیت پایه سیستمیک اسید دارد؛ آن را به عنوان یک مولفه بافر موقت کار می کند. اکسیداسیون تقریبا کامل است و کمتر از 5 درصد سیترات بدون اکسیداسیون ادرار دفع می شود. اسید سیتریک به عنوان بخشی از رژیم غذایی معمول مصرف می شود. مصرف روزانه انسان اسید سیتریک از منابع طبیعی و مواد افزودنی مواد غذایی ممکن است بیش از 500 میلی گرم بر کیلوگرم وزن بدن باشد [4،5]. اسید سیتریک از دستگاه گوارش جذب می شود و با آنزیم سیتراتا واکنش می دهد تا اسید نیتریک و اسید استیک را تولید کند [27،70]. کل اسید سیتریک در سرم انسان تقریبا 1 میلی گرم در کیلوگرم وزن بدن است.
سولفات مس یک نمک است که توسط درمان اکسید مس و اسید سولفوریک ایجاد شده است. این فرم به صورت کریستال های آبی بزرگ و آبی است که سولفات مس شامل پنج مولکول آب (CuSO4 ∙ 5H2O) و همچنین به عنوان vitriol آبی شناخته می شود. (سولفات مس) نمک بدون آب با حرارت دادن هیدرات به 150 درجه سانتیگراد (300 درجه فارنهایت) ایجاد می شود. سولفات Cupric در درجه اول برای اهداف کشاورزی، به عنوان یک آفت کش، میکروب، افزودنی های خوراکی و افزودنی خاک استفاده می شود. بعضی از مواد ثانویه سولفات مس آن به عنوان یک ماده خام در تهیه سایر ترکیبات سولفات مس به عنوان یک معرف در شیمی تجزیه ای به عنوان یک الکترولیت برای باتری ها و حمام های آبکاری استفاده می شود و در عمل پزشکی سولفات مس به عنوان یک قارچ کش، باکتری اسید و رطوبت مس یک عنصر ردیابی ضروری و یک کاتالیزور مهم برای سنتز همای و جذب آهن است. پس از سولفات مس و روی و آهک، مس سومین فراوانی عنصر ردیابی موجود است.
- کاربرد سولفات مس در کشاورزی
- کاربرد سولفات مس در تصفیه آب
-کاربرد سولفات مس در گرفتگی لوله
- کاربرد سولفات مس در دفع آفات
-کاربرد سولفات مس در کود شیمیایی
سولفات مس ف نجیب است و خواص آن عبارتند از هدایت الکتریکی حرارتی و الکتریکی، خوردگی کم، توانایی آلیاژ و قالب گیری. سولفات مس جزء دستگاه های ضد بارداری داخل رحمی (IUD) است و انتشار سولفات مس برای اثرات ضد بارداری مهم آن ضروری است. (قیمت سولفات مس و فروش سولفات مس )متوسط مصرف روزانه مس در ایالات متحده آمریکا تقریبا یک میلی گرم کروم است که رژیم غذایی آن یک منبع اولیه است. از دیگر مواد شیمیایی : تری پلی فسفات سدیم را نام برد.
اکسید آهن قرمز مصنوعی شایع ترین رنگ در سرامیک است و دارای بالاترین مقدار آهن است. اکسید آهن قرمز به صورت تجاری به عنوان یک پودر نرم و بسیار خوب ساخته شده توسط سنگ زنی مواد معدنی یا حرارت پردازش آهن / ferric سولفات و یا هیدروکسید سدیم است. در طول شلیک، تمام آهن ها به طور معمول تجزیه می شوند و رنگ های مشابهی را در لعاب ها و اجسام خاک رس تولید می کنند (اگر چه آنها دارای مقدار متفاوتی Fe ف در هر گرم پودر). اکسید آهن سرخ در رنگ های مختلف از رنگ قرمز روشن در یک مروارید قرمز عمیق استفاده می شود که به طور معمول توسط یک مقیاس از حدود 120-180 تعیین می شود (این عدد باید بر روی کیسه ها از تولید کننده باشد، رنگ های تیره تر اعداد بالاتر )، با این حال اکسید آهن قرمز در سرامیک این نمرات مختلف باید همه دمای آتش را به دمای مشابهی از آنجا که آنها مقدار آهن مشابه است. رنگ های خام متفاوت اکسید آهن قرمز محصول درجه آسیاب هستند. اکسید آهن قرمز و اکسید آهن دارای کاربردهای متفاوتی می باشد. کاربرد اکسید آهن قرمز در صنعت بسیار مهم است.
در اکسیداسیون شلیک آهن بسیار مقاوم است، به طوری که غیر ممکن است، حتی در یک frit بسیار ذوب، تولید یک لعاب فی. اکسید آهن قرمز، این یک منبع مهم برای رنگ قهوه ای، قرمز قهوه ای و قهوه ای در لعاب ها و بدن است. به عنوان مثال، رنگ قرمز آهن، وابسته به کریستالیزاسیون آهن در یک ماتریس لعاب سیال و نیاز به مقادیر زیاد آهن موجود (به عنوان مثال 25٪). رنگ قرمز بدن terra cotta از آهن، معمولا حدود 5٪ یا بیشتر، و از بدن متخلخل است. وقتی این اجسام به دماهای بالاتر اخراج می شوند، رنگ به رنگ قرمز عمیق تر و در نهایت قهوه ای تبدیل می شود. داستان شبیه بدن های متوسط آتش است. قیمت اکسید آهن قرمز به آسانی قابل دسترسی است.
از جمله کاربردهای پلی آلومینیوم کلراید می توان به مواردی اشاره کرد. از آن موارد به کاربرد پلی آلومینیوم کلراید به شرح زیر اشاره کرد:
سهولت کاربرد
آب کم و کم آب بسیار مؤثر است.
تشکیل سریع و بهتر Floc در مقایسه با Alum.
کاهش pH کمتر نسبت به آلوم.
تولید لجن بسیار کمتر است.
هیچ اام دیگری برای کمک به فلوکوزیس وجود ندارد.
کاهش زمان رسوب
موثر در محدوده pH وسیع.
پایین تر آلومینیوم و سایر فات سنگین در مقایسه با سولفات آلومینیوم.
مکانیسم هایپلی آلومنیوم کلراید(PACl) در دوزهای مختلف با استفاده از یک آزمون معمول جار با مقادیر مختلف نهایی و اولیه pH در طی درمان سوسپانسیون کائولین مورد بررسی قرار گرفت. pH نهایی مطلوب و دوز برای PACl بر اساس کدورت و پتانسیل زتا از فلک ها به دست آمد. مناطق انعقادی در دوزهای مختلف PACl و مقادیر pH محلول تهیه شده و با آن ها مقایسه شده است. مشخص شده است که مکانیزم بهینه در شرایط اسیدی، خنثی سازی شارژ است، در حالی که شرایط قلیایی، انعقاد PACl را تسهیل می کند. هر دو انعقاد تخلیه شارژ و انعقاد جاروب می توانند راندمان انعقادی بالا را در شرایط قلیایی از pH 7.0 تا 10.0 نهایی به دست بیاورند. تثبیت، عدم ثبات، خنثی سازی شارژ، بازگرداندن و جابجایی به صورت پیوسته با افزایش مقدار DACP با مقادیر pH پایدار در 7.0 و 8.0 ثابت می شود، اما در منطقه ناپایداری pH 10.0، pH ناپدید می شود. هنگامی که pH نهایی کنترل نمی شود و در نتیجه با افزایش مقدار PACl کاهش می یابد، هیچ نوع زه کش معمولی مشاهده نمی شود (فروش پلی آلومنیوم کلراید) و راندمان انعقادی در مقدار DACP بالا کاهش می یابد. به نظر می رسد که PH نهایی معنی دار تر از pH اولیه برای انعقاد است. راندمان انعقاد خنثی سازی شارژ توسط پتانسیل زتا از فلک ها و رسوبات PACL غلبه می شود. خنثی سازی شارژ و جابجایی مناطق انعقادی PACl در محدوده های دوز و انعقاد کوآلولانت بیشتر از آلوم است. نتایج برای ما مفید است برای درمان آب و فاضلاب با استفاده از PACl و درک روند انعقاد PACl.
از جمله موادی كه بشر از قديم بكار ميگرفته آهك است . کشف آهك مربوط به زماني است كه انسان آتش را كشف كرد، . ايرانيان قديم نيز آهك را بخوبي ميشناختند و نمونههاي بسیاری از كاربرد آهك بعنوان سيمان و ملات در ساخت ساختمان هاي تاريخي بدست آمده است. اما مشكل شناخته شده آهك، عدم مقاومت آن در برابر آب بود. جهت رفع اين معضل، مخلوطي از آهك و ماسه و خاك رس و لويي (سر نوعي ني) به اسم ساروج بكار گرفته می شد كه در مقابل آب مقاوم بود. آهك علاوه بر كاربردهاي ساختماني ،در صنايع كاغذ سازي ، تولدي كاربيد كلسيم، تصفيه آب ، توليد گيريس ،خنثي كردن اسيدهاي فاضلاب، مواد غذايي حيوانات ، معادن زغال سنگ ،جلوگيري از انفجار گاز زغال، خنثي كنندهها و … نيز بكار ميرود. خوشبختانه در ايران، معادن زيادي از سنگ آهك مرغوب مخصوصاً سنگ هاي رسوبي داريم. ام برخلاف صنعت توليدگچ كه در آن پيشرفت خوبي داشتهايم، در مورد آهك چنين نبوده است. البته اخيراً كارخانههايي جهت توليد آهك صنعتي احداث شده. اما در هر صورت هم اكنون آهك آماده در بازار مصالح ساختماني وجود ندارد. در مورد فروش آهک و قیمت آهک و خرید آهک امروزه می توان به راحتی اطلاعات را پیدا کرد.
در مورد یک نوع دیگر از مواد شیمیایی باید به معرفی آهک هیدراته پرداخت. آهک هیدراته، آهک خالص سفید رنگی می باشد اما با وجود ناخالصی ها می تواند تا حدودی باعث تغییر رنگ آن شوند، اگرچه ناخالصی های سنگ آهک ، کربنات منیزیم باشد سنگ آهک دولومیتی نامیده می شود و از پختن آن آهک منیزیومی حاصل می شود، زمانیکه ناخالصی سنگ آهک مواد رسی و سیلیسی باشد، پختن آن بسته به مقدار ناخالصی ، آهک نیمه آبی یا آهک آبی تهیه می شود.
.منبع: لینک منبع
اسید استیک جز اسیدهای کربوکسیلیک میباشد و اسید استیک در نامگذاری آیوپاک به اسید اتانوئیک معروف است. اسید استیک در قسمت چشایی طعم ترشی ، شبیه طعم سرکه میدهد.
باکتری های سرکه به دلیل رغبت به تولید اسید استیک به این نام معروف شدند. باکتری ها در مواد غذایی ، آب و خاک یافت میشوند. اسید استیک بطور طبیعی از میوهها و برخی مواد غذایی فاسد شده تولید میشوند و از قدیمیترین ترکیبات شیمیایی شناخته شده میباشد.
قیمت اسید استیک (اسید استیک ) برای انسان ها مشکل بوده است. احتمالاً انسانها در دوران باستان در تهیه شراب از فرایند تخمیر به وجود سرکه متوجه شده بودند.
از کاربردهای اسید استیک می توان به ین ماده و به عنوان ماده واسطه در تولید ماده استات وینیل را که ترکیب مهمی در تولید چسب و رنگ میباشد، کاربرد دارد. بعضی از استرهای اسید استیک به عنوان ماده ای حلال در تولید مواد معطر مصنوعی استفاده میشوند. فروش اسید استیک و فروش اسید فسفریک به دو شکل می باشد. به شکل فله تانکر 23000 لیتری و بشکه های 230 لیتری به می باشد.
معرفی یک نمونه دیگر از اسید ها اسید فسفریک و اسید فسفریک خوراکی می باشد. اسید فسفریک یک اسید پرکاربرد می باشد. از اسید فسفریک برای تهیه و تولید مواد منعقد کننده و مواد تصفیه کننده آب و فاضلاب استفاده می شود.
منبع: لینک منبع
هیدروژن پراکسید، یک نوع اکسیژن واکنشی با خواص شیمیایی منحصر به فرد، در سیستم های زنده به عنوان یک اکسید کننده مخرب برای جدا کردن پاتوژن ها یا به عنوان پیام رسان دوم ریز تنظیم شده در مسیرهای سیگنالینگ سلولی پویا تولید می شود. برای درک نقش های پیچیده ای که پراکسید هیدروژن می تواند در سیستم های بیولوژیکی بازی کند، ابزار جدید برای نظارت بر پراکسید هیدروژن در تنظیمات بومی خود، با انتخاب انتخابی و حساسیت بالا، مورد نیاز است. آگاهی از واکنش های ترکیب شیمیایی آلی، پایه ای برای طراحی مولکول پروب های پراکسید هیدروژنی انتخابی و عملکردی است. یک پالت از پروب های فلورسنت و لومینسنت که شیمی درمانی با پراکسید هیدروژن واکنش نشان می دهد، با استفاده از یک ماژور اکسیداسیون بورون توسعه یافته است.
هیدروژن پراکسید یکی دیگر از عامل های قوی اکسید کننده است که به هیدروژن (H+) و هیدروکسیل (OH-) رادیکال است. این عوامل اکسیداتیو به راحتی پروتئین ها، چربی ها و اسیدهای نوکلئیک را متلاشی می کنند، هرچند که آب اکسیژنه باعث مرگ سلول ها نمی شود. تولید آب اکسیژنه به صورت صنعتی صورت می گیرد. تصور می شود که آن را در ارتباط با آهن موجود در میکروارگانیسم ها برای تسهیل اثر ژرمی کایشی کار می کند. در حضور نقره پیشنهاد می شود که فعالیت پراکسید هیدروژن از طریق آسیب هایی که به آنزیم های غیرفعال کننده آب اکسیژنه وارد می شود افزایش یابد.
قیمت آب اکسیژنه به صورت مقرون به صرفه است.پراکسید هیدروژن جامد را مستقیما به رنگ خون وارد کنید، و اجازه دهید آن را بنشینید تا زمانی که فیستینگ متوقف شود. سپس آن را با دستمال پارچه ای پاک کنید تا آن را بردارید. فرایند را تا زمانی که رنگ رفته است، تکرار کنید. شستن لباس مانند شما به طور معمول. اگر مطمئن نیستید که به طور کامل لکه دار شده اید، مطمئن شوید قبل از اینکه لباس خود را در خشک کن بریزید، بررسی کنید. لکه های حرارت دهنده برای حذف دشوار است. ترکیب دو قسمت آب اکسیژنه و یک قسمت ظرف با ظرف را برای ایجاد پاک کننده رطوبت خود ایجاد کنید. آن را به لکه با یک برس نرم خمیری بمالید و آن را کمی بشویید. سپس، تحت آب سرد شستشو دهید. اگر هنوز می توانید علامت های رنگ را مشاهده کنید.
تولید اسید فسفریک یکی از چالش برانگیزترین صنایع مخلوط است. فرایند تولید شامل یک سری مخازن واکنشی است که در آن فسفات با اسید سولفوریک واکنش داده می شود. همزن ها و قطعات مرطوب در معرض مایعات و بخار خوردگی قرار می گیرند که تجهیزات چرخش را از بین می برند. سنگ فسفری بلور می شود و در ناحیه های مرده در هر حلقه به دام می افتد و باعث می شود که ذرات به هم متصل شوند و هسته ای از سنگ های غیر واکنش را ترک کنند که باعث کاهش تولید می شود و تمایل به پیوستن به دیواره های کشتی و سطوح پروانه می باشد. انباشته شدن اسید فسفریک می تواند به اندازه کافی بزرگ برای شکستن و از بین بردن پروانه ها، شفت ها یا درایو های مخلوط با بارهای ناگهانی شوک شود. نتیجه یک فرآیند مخلوط کردن ناکارآمد با بازده مواد نامطلوب و خرابی تجهیزات مزمن است.
در تولید اسید فسفریک با استفاده از فرآیند پذیرفته شده صنعت، ذرات فسفات ذرات ریز به دلیل میزان مخلوط در مخزن توزیع می شوند. فرایندهای مخلوط متعارف به مناطق مرده اجازه می دهد تا دیواره های حلقوی و آگلومره های کریستال گچ را تشکیل دهند و ذرات بزرگتر را با سنگ های غیر واکنشی در هسته خود تشکیل دهند. ذرات بزرگ معمولا دیواره های مخزن را پوشانده اند، جایی که قطعه ها می توانند سقوط کنند و شکست بخورند یا باعث ایجاد شرایط کار خطرناک در حین تعمیر و نگهداری شوند. همان طور که گچ بر روی دیوار اثر می گذارد، خروجی کاهش می یابد و به سودآوری برسد. تولید کنندگانقیمت اسید فسفریک را به گونه ای قیمت گذاری کرده اند که مشتریان عزیز ما بتوانند با هر بودجه ای تهیه نمایند و بتوانند فروش اسید فسفریک و فروش اسید سولفوریک را برای استفاده داخلی فراهم نمایند.
توانایی بهبود مخلوط کردن مخزن در اوایل فرایند برای بهبود قابلیت اطمینان مکانیکی مخلوط های راکتور بسیار مهم است. عملکرد پروانه های طراحی شده ما، معیارهای طراحی مکانیکی و طرح های اتصال سفت و سخت همچنان به آزمون زمان برسند. موفقیت ما حادثه نیست. عملکرد فرآیند ما باعث ریشه یابی ریشه ها می شود که منجر به شکست می شود.
همانطور که میدانید سود پرک دارای اسم دیگر کاستیک سود و یا هیدروکسید سدیم می باشد. اگر بخواهیم تعریفی از سود پرک داشته باشیم باید گفت سود پرک ماده ای سفید رنگ می باشد و همچنین سود پرک ماده اولیه مورد نیاز صنایع تولیدی می باشد. سود سوزآور از مایع پتروشیمی تولید ی شود.
سود پرک و همچنین تولید کننده سود پرک دارای مزایا و کاربردهای متفاوتی می باشد. از مزایای سود پرک می توان به مواردی اشاره کرد که در ادامه به ذکر برخی از آن ها می پردازیم.برای مثال می توان به کاربرد سود پرک در صنایع کاغذ و یا صنایع چرم ، در نفت و گاز و پتروشیمی، الکل سازی و آرایشی و بهداشتی ، همچنین می توان در صنایع شیشه و گالوانیزه نیز استفاده کرد. سود سوزآور ماده قلیایی است که با توجه به غلظت ، pH آن تغییر پیدا می کند.، محلول ۵۰ درصد سود مایع به عنوان یک ماده قلیایی قوی شناخته می شود. برای تأمین سود پرک یا سود مایع روش های مختلفی وجود دارد، در شهر تهران برای خرید سود پرک می توان به شرکت های مختلف تولید کننده و فروشنده مراجعه نمود و نیز از قیمت سود پرک نیز مطلع شد، سود پرک را با کیفیت های مختلف و قیمت های متفاوت تهیه کرد. سود سوز آور در صنایع شیمیایی مورد استفاده قرار می گیرد به عنوان مثال برای کنترل PH ،خنثی کردن اسید،کاتالیست و پاک کردن گازها همچنین در صنایع کاغذ سازی و خمیر کاغذ سازی،صنعت پتروشیمی و خنثی کردن گازها(اسیدهای آلوده را در پروسه گازها و روغنها دوباره مورد استفاده قرار می دهد).
منبع: لینک منبع
اسید سولفوریک یک مایع روغنی بی رنگ است.اسید سولفوریک در آب با انتشار گرما است. این فات و بافت خورنده است. چوب چوب و اکثر مواد آلی دیگر در تماس است، اما بعید است که اسید سولفوریک باعث آتش سوزی شود. اسید سولفوریک در معرض قرار گرفتن در معرض بلند مدت با غلظت های پایین و یا در معرض قرار گرفتن در معرض قرار گرفتن در معرض قرار گرفتن در معرض قرار گرفتن در معر اسید سولفوریک برای تولید کودهای شیمیایی و سایر مواد شیمیایی، در فرآوری نفت، در تولید آهن و فولاد و برای بسیاری از کاربرد اسید سولفوریک می باشد.
اسید سولفوریک است که متشکل از دو اکسو و دو گروه هیدروکسیونی است که به طور مشترک به یک اتم گوگرد مرکزی متصل می شوند. این نقش به عنوان یک کاتالیزور نقش دارد. این یک اسید سولفوریک متصل شده از یک هیدروژنسولفات است. اسید سولفوریک می توانند به عنوان هسته های فشرده ابر عمل کنند و این باعث می شود که تعداد بیشتری قطرات آب کوچکتر به وجود آید. بسیاری از قطرات کوچکتر می توانند نور را بهتر از چند قطره بزرگتر پخش کنند. امکان فروش اسید سولفوریک و همچنین خرید اسید سولفوریک به صورت اینترنتی نیز فراهم شده است.
اسید سولفوریک خالص دارای وزن مخصوص 1.830 در دمای 25 درجه سانتیگراد (77 درجه فارنهایت) است. آن را در دمای 10.37 درجه سانتیگراد (50.7 درجه فارنهایت) انجماد می کند. هنگامی که گرم می شود، اسید خالص به طور جزئی به آب و سولفور تری اکسید تجزیه می شود. دوم آن را بخار می کند تا غلظت اسید به 98.3 درصد برسد.
هیدروکسید سدیم یا سود پرک در فرم جامد، همچنین به نام سدیم سودا، یک ترکیب شیمیایی غیر معدنی متعلق به قویترین ماده قلیایی است. سود پرک فرم جامد، آن یک ماده سفید با ظاهر کریستالی (فلکس) است. این خواص هیدروژنی دارد. سود پرک کاملا محلول در آب است که باعث تشکیل لکه های خورنده می شود که با انتشار مقدار قابل توجهی از گرما همراه است.
هیدروکسید سدیم در گروه PCC در فرآیند الکترولیز غشا تولید می شود. در میان خواص شیمیایی سود پرک را از رقابت جدا می کند، محتوای کلرید کم (<200 ppm) و آهن (<15 ppm) قابل توجه است. تولید کننده سود پرک زحمت زیادی برای این فرایند انجام میدهند.در فرایند تولید فقط ترکیبات معدنی استفاده می شود. بنابراین این محصول می تواند مورد نیازباشد. هیدروکسید سدیم با موفقیت در صنایع مانند شیمیایی، منسوجات، شیمی خانگی، پالپ و کاغذ، لاستیک و داروها استفاده می شود. هیدروکسید سدیم ( سود سوزآور ) یکی از مواد اولیه مورد استفاده در هر صنعت است.قیمت سود پرک با توجه به مراحل و هزینه های سختی که برای تولیدش استفاده می شود، دارای قیمت مقرون به صرفه و مناسبی است.
در صنایع پتروشیمی، هیدروکسید سدیم یا سود پرک برای پالایش نفت خام، روغن های معدنی، رزین ها و آسفالت ها و استخراج گاز شیل استفاده می شود. در پالایشگاه ها و کارخانه های کوک، سود سوزی برای اصلاح محصولات حاصل از زغال سنگ کک می باشد. در صنایع فولاد و متالورژی سود پرک در فرآیند تولید آلومینیوم از فرایند بوکسیت دخیل است. سودا یا سود پرک نیز در صنعت کاغذ و صنایع سلوی به طور گسترده ای مورد استفاده در روند چوب چوب خمیر مورد استفاده برای تولید کاغذ یا بازسازی الیاف سلو است. کاستیک سودا در صنعت لوازم آرایشی و بهداشتی در تولید صابون سخت (سدیم)، مواد شوینده، ماسک های لایه برداری (لایه برداری، شبیه سازی شیمیایی) و آسپتیک استفاده می شود. همچنین نقش مهمی در چندین مرحله بعد سفید کردن پالپ قهوه ای که از فرایند خمیردندان دارد، این مراحل شامل تجزیه اکسید اکسیژن، استخراج اکسیداتیو و استخراج ساده است که تمامی آنها نیاز به یک محیط قوی قلیایی با pH> 10.5 در پایان مراحل دارند. هیدروکسید سدیم یک ماده مهم در تولید سورفکتانت ها، شستن مایعات و پودر ها، مواد پاک کننده و نرم کننده های آب است. در فرم مایع جزء مواد شوینده مختلف است. در صنعت نساجی سود پرک در تولید رنگ و مصنوعی استفاده می شود. در فرایند تصفیه آب با افزایش pH، آب دارای اثر خوردگی کمتر بر روی نصب آب است و علاوه بر این، میزان سرب، مس و دیگر فات سمی را که می تواند در آب آشامیدنی حل شود، کاهش می دهد.
هیدروکسید سدیم یکی از بنیادی ترین مواد در صنعت است. استفاده اصلی آن در صنعت کاغذ، صنعت نفت، صنایع نساجی، تولید صابون و مواد شوینده در فرایند تولید آلومینیوم، تمیز کردن صنعتی و تنظیم PH می باشد. همچنین برای صنایع مختلف برای بسیاری از کاربردها استفاده می شود.
خطرات ایمنی: این قلیایی قوی و بسیار خورنده است که به راحتی بافت های زنده را تجزیه می کند. تماس پوست با محلول های NaOH می تواند باعث سوختگی شدید شیمیایی شود و تماس با چشم می تواند باعث کوری دائمی شود. NaOH جامد با آب و اسیدها در یک واکنش بسیار اکسوترمی واکنش می دهد و می تواند باعث سوختگی ها از طریق اسپاسم شود.
هیدروکسید سدیم یکی از رایج ترین مواد معدنی یا قلیایی است. این نیز سودا یا قهوهای مایل به زرد است.
با استفاده از فرآیند الکترولیتی کلرکلکالی تولید می شود که در آن الکترولیز محلول سدیم کلرید حاوی گاز کلر و هیدروکسید سدیم می باشد. NaOH به عنوان یک محلول 50٪ در آب به دست می آید و سپس برای خشک کردن تکه های جامد هیدروکسید سدیم خشک می شود.
خواص فیزیکی: جامد بلوری بی بو، با تراکم 2.13 گرم در میلی لیتر و نقطه ذوب 318 درجه سانتیگراد است. این پودر به طور گسترده ای به عنوان پلت ها، دانه ها و همچنین به عنوان راه حل های آبی از غلظت های مختلف در دسترس است.
محلول در حلال های قطبی مانند آب، اتانول و متانول است و در حلال های آلی قابل حل نیست. محلول جامد NaOH در آب یک واکنش بسیار خنثی است و باعث خنثی شدن آن می شود. محلول NaOH یک پایه بی رنگ، بی بو و مهم است که در آزمایشگاه استفاده می شود. به عنوان یک پایه قوی، هیدروکسید سدیم به راحتی با اسید هایی مانند HCl واکنش می دهد تا نمک های مربوطه را شکل دهند.
هیدروکسید سدیم بسیار هیدروسکوپیک است (آب را از هوا جذب می کند) و همچنین دی اکسید کربن را از هوا جذب می کند.
سولفات مس یک ترکیب غیر معدنی است که گوگرد را با مس ترکیب می کند. این می تواند باکتری ها، جلبک ها، ریشه ها، گیاهان، حون ها و قارچ ها را از بین ببرد. سمیت سولفات مس بستگی به محتوای مس دارد. مس یک ماده معدنی ضروری است. این می تواند در محیط، غذاها و آب یافت شود. سولفات مس برای استفاده در محصولات آفت کش در ایالات متحده از سال 1956 ثبت شده است.
برخی از محصولات که حاوی سولفات مس هستند چیست؟
محصولات حاوی سولفات مس می تواند مایع، گرد و غبار یا کریستال باشد. چندین محصول فعال شامل سولفات مس در بازار ایالات متحده وجود دارد. بعضی از این ها برای استفاده در کشاورزی آلی مورد تایید قرار گرفته اند.
همیشه دستورالعمل های برچسب را دنبال کنید.
چگونه سولفات مس کار می کند؟
مس در سولفات مس در قارچ ها و جلبک ها به پروتئین ها متصل می شود. این باعث آسیب سلول ها به آنها می شود و آنها را نشت می کند و می میرد. در حون ها، مس عملکرد عادی سلول های پوست و آنزیم ها را مختل می کند.
چگونه می توانم در معرض سولفات مس قرار بگیرم؟
اگر سولفات مس را استفاده می کنید می توانید در معرض آن قرار گیرید و آن را بر روی پوست خود قرار دهید، در آن نفس بکشید یا به طور تصادفی یک محصول بخورید یا بنوشید. این نیز می تواند اتفاق بیافتد، با توجه به دستورالعمل های برچسب به دقت، می توانید قرار گرفتن در معرض آن را محدود کنید و خطر را کاهش دهید.
برخی از علائم و نشانه ها از مواجه شدن کوتاه مدت با سولفات مس چیست؟
سولفات مس ممکن است موجب تحریک شدید چشم شود. خوردن مقدار زیادی سولفات مس منجر به تهوع، استفراغ و آسیب به بافت های بدن، سلول های خونی، کبد و کلیه می شود. با قرار گرفتن در معرض شدید، شوک و مرگ ممکن است رخ دهد.
سولفات مس بر روی حیوانات به شیوه ای مشابه تاثیر می گذارد. علائم مسمومیت در حیوانات شامل عدم اشتها، استفراغ، کم آبی، شوک و مرگ است. اسهال و استفراغ ممکن است از سبز تا آبی رنگ باشد. اطلاعات حقوقی مربوط به استفاده از حیوانات خانگی و آفت کش ها را ببینید.
چه اتفاقی می افتد وقتی سولفات مس وارد بدن می شود؟
مس یک عنصر ضروری است و برای حفظ سلامت مناسب لازم است. بدن انسان برای حفظ تعادل مس، بدن انسان را تنظیم می کند. سولفات مس در صورت خوردن یا استنشاق جذب بدن می شود. سپس به سرعت وارد جریان خون می شود. هنگامی که داخل بدن شود، مس در سراسر بدن حرکت می کند. سپس آن را به پروتئین ها متصل می کند و وارد ارگان های مختلف می شود.
مس بیش از حد دفع می شود و اغلب در بدن ذخیره نمی شود. مس را می توان در کبد جمع آوری کرد، اما می توان آن را در ترشحات معده، استخوان، مغز، مو، قلب، روده، کلیه ها، عضلات، ناخن ها، پوست و طحال یافت. مس عمدتا در مدفوع دفع می شود. مقدار کمی نیز می تواند در مو و ناخن حذف شود. در یک مطالعه، محققان دریافتند که برای نیمی از دوز بالای مس که از بدن دفع می شود، 13 تا 33 روز طول می کشد.
آیا سولفات مس احتمالا به توسعه سرطان کمک می کند؟
این که آیا سولفات مس باعث ایجاد سرطان در حیوانات می شود، نامشخص است. اداره حفاظت از محیط زیست ایالات متحده (U.S. EPA) یک رتبه بندی سرطان برای سولفات مس منتشر نکرده است. این به دلیل فقدان شواهدی است که نمکهای مس و مس را برای توسعه سرطان در حیواناتی که معمولا می تواند مس را در بدن آنها تنظیم کند، مرتبط می کند.
یک مطالعه در معرض مواجهه طولانی مدت با سولفات مس به نظر می رسید. آنها خطر ابتلا به سرطان کلیه را افزایش دادند. مطالعه دیگری نشان داد که کاهش مس باعث مهار رشد سرطان می شود. مطالعات حیوانی نتیجه های متضاد را ارائه داده اند.
اثرات غیر سرطانی از مواجهه شدن به مدت طولانی با سولفات مس
مطالعات در مورد اثرات غیر سرطانی برای مدت طولانی مواجه بودن با سولفات مس نشده است. با این حال، بیماری ویلسون ممکن است بینظمی را در مورد اثرات بالقوه سلامتی در مدت زمان طولانی ارائه دهد. بیماری ویلسون یک اختلال ژنتیکی نادر است که در آن بدن، مس بیش از حد را حفظ می کند. اثرات ناباروری، میزان سقط جنین، از دست دادن مردانگی و عدم تعادل هورمونی در ن است. در مردان، تیروئید به درستی کار نمی کند. قرار گرفتن در معرض سولفات مس باعث ایجاد بیماری ویلسون نمی شود.
در یک مطالعه، موش ها مقدار زیادی از سولفات مس را قبل و بعد از حاملگی تغذیه می کردند. بعضی از موش ها در طی بارداری جان خود را از دست دادند یا به طور طبیعی کودک رشد نمی کرد.
آیا کودکان نسبت به سولفات مس نسبت به بزرگسالان حساسیت بیشتری دارند؟
در مقایسه با بزرگسالان، کودکان ممکن است نسبت به آفت کش ها حساس باشند. با این حال، در حال حاضر هیچ اطلاعاتی برای نتیجه گیری وجود ندارد که کودکان حساسیت خاصی به سولفات مس داشته باشند.
چه اتفاقی برای سولفات مس در محیط می افتد؟
مس به طور طبیعی در محیط زیست رخ می دهد. مس در خاک ممکن است از منابع طبیعی، آفت کش ها یا سایر منابع تولید شود. این ممکن است شامل معدن، صنعت، مواد معماری و وسایل نقلیه موتوری باشد. مس عمدتا در سطح خاک تجمع می یابد، جایی که آن را به شدت متصل می کند و همچنان ادامه می یابد.
سولفات مس در آب بسیار محلول است و می تواند به رسوبات متصل شود. مس توسط گیاهان تنظیم می شود، زیرا این ماده معدنی ضروری است. مسکن بیش از حد می تواند برای گیاهان سمی باشد چرا که فتوسنتز را مهار می کند.
آیا سولفات مس بر روی پرندگان، ماهی یا حیات وحش دیگر تاثیر می گذارد؟
ایالات متحده معتقد است که مس عموما غیر مسموم به زنبورها و نسبتا سمی به پرندگان است. مطالعاتی که با گونه های مختلف آبزی انجام شده، مس را به شدت سمی برای ماهی و زندگی آبزی می دانند.
پس از استفاده از سولفات مس برای کنترل جلبک ها در حوضچه ها و دریاچه ها، کشتن ماهی ها گزارش شده است. کاهش اکسیژن و افزایش آلودگی به عنوان علت بیشتر مرگ و میرهای ماهی اشاره شده است. این گاهی اوقات به دلیل مرگ و میر ناگهانی جلبکها و گیاهان پس از یک برنامه کاربردی است. حتی غلظت های کوچک مس ممکن است برای ماهیان و موجودات زنده مضر باشد. همیشه از دستورالعمل های برچسب برای محافظت از محیط زیست استفاده کنید.
پودر اکسید آهن قرمز توسط بسیاری از صنایع استفاده می شود. این یک ترکیب غیر معدنی است که در هند در فراوانی بسیار زیاد در مناطق مختلف موجود است. این یکی از مهمترین مواد معدنی است که در کارخانه فولاد مورد استفاده قرار می گیرد. این مقاله در مورد برخی از کاربردهای بسیار محبوب اکسید قرمز همراه با خواص آن است که در زمینه ساخت آن برای صنایع مختلف سودمند است. اجازه دهید ما به این برنامه های مختلف نگاه کنیم.
1.صنعت رنگ
این یکی از محبوب ترین مواد معدنی در صنعت رنگ است. این تنها و بزرگترین رنگدانه است که بخش مهمی از هر رنگ است. این رنگ زیبا را به رنگ ها اضافه می کنند و باعث می شود رنگ ها زرق و برق دار باشند.
2.صنعت آهن
یکی دیگر از کاربردهای بسیار مهم اکسید قرمز به عنوان ماده اولیه در فرآیند تولید صنایع آهن و فولاد و سایر آلیاژهای دیگر است. بدون این مواد معدنی، تولید چنین مواد معدنی مهم امکان پذیر نیست.
.3پرداخت
پودر بسیار سختی از اکسید آهن به عنوان روژ شناخته شده است. آن را در قرار دادن پوشش نهایی لهستانی در انواع جواهرات فی و لنز استفاده می کنند. یکی دیگر از استفاده بسیار مهم از اکسید آهن که باعث می شود آن را بسیار محبوب در صنعت کند، استفاده جواهرسازان برای به دست آوردن یک جواهرفروشی عالی است.
.4کاشی و سرامیک صنعت
اکسید قرمز طبیعی اولین و مهمترین اولویت رنگدانه طبیعی کاشی و سرامیک است. این بطور گسترده در سفال سرامیک، کاشی های کف و کفپوش استفاده می شود. همچنین در ارائه یک رنگ قرمز به سیمان استفاده می شود.
5.صنایع پلاستیک و لاستیک
اکسید قرمز طبیعی نیز در صنایع پلاستیک و لاستیک برای اضافه کردن رنگ زیبا به پلاستیک و لاستیک استفاده می شود. گاهی اوقات پودر اکسید قرمز مصنوعی نیز برای همین هدف مورد استفاده قرار می گیرد.
اینها کاربردها و کاربردهای مختلف اکسید قرمز هستند. به دلیل رنگ و مقاومت آن در صنایع مختلف بسیار کاربرد دارد.
اسید سیتریکچه ماده شیمیایی است؟
اسید سیتریک به عنوان اقتصادی ترین محصول تولید میولوژیکی در نظر گرفته می شود ، بنابراین مطالعات در مورد مواد اولیه ارزان و تجدید پذیر برای تولید آن بسیار مطلوب است اسید سیتریک یک پودر کریستالی سفید و بی بو است که به طور طبیعی در مرکبات مشاهده می شود. اسید سیتریک با بی کربنات سدیم اساس بمبهای منفجره را می تواند تشکیل می دهد. با افزودن آب ، این دی اکسید کربن ایجاد می کند و باعث ایجاد حباب و لکه دار می شود. می توان بسیاری از رنگ ها ، رایحه ها ، روغنهای اساسی ، گل و گیاهان اضافه کرد تا بالستیک های معطر منحصر به فردی ایجاد شود.
اسید سیتریک اولین بار در سال 1784 (از آب لیمو کریستالیزه شده) توسط یک شیمیدان سوئدی ، کارل ویلهلم شل جدا شد. اسید سیتریک یک اسید میوه طبیعی است. در لیموها و لیموترش ها می تواند تا 8٪ وزن خشک را به خود اختصاص دهد و طعم بسیار اسیدی دارد.
اسید سیتریک را از طریق تهیه کنندگان اروپایی خریداری می کند ، که آن را از سبزیجات اصلاح نشده ژنتیکی و ملاس های استخراج شده از آنها تولید می کنند.
اسید سیتریکیک ماده مفید در نوشیدنی ها ، مرباها ، ژله ها ، آب نبات ها و غذاهای یخ زده است. همچنین در دسرهای ژلاتینی و میوه ای و همچنین در سبزیجات کنسرو شده و محصولات گوشتی اضافه می شود. اسید سیتریک مواد غذایی را حفظ کرده و طعم را تقویت می کند. اسید سیتریک یکی از مواد مفید در صنایع غذایی و آشامیدنی است.
نمک های سیترات فات مختلف برای تهیه این اسید سیتریک به شکل بیولوژیکی در بسیاری از مکمل های غذایی استفاده می شود. از خواص بافراسید سیتریک برای کنترل pH در پاک کننده های خانگی و دارویی استفاده می شود.
توانایی اسید سیتریک در کلات کردن فات باعث می شود در صابون ها و مواد شوینده لباسشویی مفید باشد. بفات در آب سخت ، به این تمیز کننده ها اجازه می دهد تا بدون نیاز به نرم شدن آب ، کف تولید کنند و با کارآیی بیشتری داشته باشند.
به طور مشابه ، از اسید سیتریک برای بازگرداندن مواد تبادل یونی که در نرم کننده های آب استفاده می شود با جدا کردن یون های فی انباشته شده به عنوان مجتمع های سیترات استفاده می شود. اسید سیتریک در صنایع بیوتکنولوژی و داروسازی مورد استفاده قرار می گیرد تا لوله های فرایند خلوص بالا را به عنوان جایگزینی برای استفاده از اسید سیتریک در لوله های جایگزین قرار دهند. اسید سیتریک پس از استفاده برای این منظور ، یک مسئله دفع خطرناک است ، در حالی که اسید سیتریک نیست. اسید سیتریک به عنوان بی خطر برای استفاده در مواد غذایی توسط کلیه آژانسهای مهم تنظیم ملی مواد غذایی و بین المللی شناخته می شود. به طور طبیعی تقریباً در تمام اشکال زندگی وجود دارد و اسید سیتریک اضافی به راحتی متابولیزه و از بدن خارج می شود.
اسید سیتریک یک اسید کمی قوی تر از اسیدهای کربوکسیلیک معمولی است. این امر به این دلیل است که آنیون با پیوند هیدروژن بین مولکولی از سایر گروههای پروتئینی روی اسید سیتریک تثبیت می شود.در دمای اتاق ، اسید سیتریک یک پودر بلوری سفید است. این بیماری می تواند به صورت بی آب (بدون آب) یا به صورت منوهیدرات وجود داشته باشد. فرم بدون آب از آب گرم تبلور می یابد. وقتی اسید سیتریک از آب سرد تبلور می شود ، منوهیدرات تشکیل می شود.
امروزه در تولید بیوتکنولوژیک اسید سیتریک ، به اصطلاح "فرآیندهای زیر آب" استفاده می شود. قارچ Aspergillus niger در بیوآکتورهای بسته کشت می شود تا ماده مورد نظر را در محلول غذایی حاوی شکر تولید کند. برای اینکه سلولهای قارچی در مقادیر زیادی اسید سیتریک تولید کنند و یا به عبارتی برای تولید بیش از حد آن ، اسید را مجبور به خارج از سلول کنند.
کرینات سدیم سنگین
خاکستر سودا، نام تجاری برای کربنات سدیم (Na2CO3)است،کربنات سدیم یک ماده سفید، بدون آب، پودر یا دانه ای است. کربنات سدیم خام اولیه مورد استفاده در تولید شیشه، مواد شوینده شیمیایی و سایر محصولات صنعتی است. کربنات سدیم به دو دسته کزینات سدیم سبک و کرینات سدیم سنگین تقسیم می شود. به همین ترتیب، کربنات سدیم در تولید بیش از 5000 سال استفاده شده است. مصری های باستان از آن برای ساخت شیشه و عروق استفاده می کردند. آنها محصول را از ذخایر تجمعی دریاچه خشک یا با سوزاندن جلبک دریایی و دیگر گیاهان دریایی بازیافت کردند. رومی ها نیز از خاکستر سودا برای نان پخت، شیشه و برای مقاصد پزشکی استفاده می کردند. استخراج آن از خاکستر گیاهان مختلف تا اواسط قرن نوزدهم ادامه یافت و نام آن را "خاکستر سودا" نامید.
امروزه " کربنات سدیم سبک " از ترون مواد معدنی تصفیه شده و به عنوان استاندارد برای کیفیت و خلوص مورد استفاده قرار می گیرد و همچنین از نمک های سدیم کربنات تحمل می شود. همچنین "خاکستری سودا مصنوعی" وجود دارد که با استفاده از تعدادی از فرآیندهای شیمیایی مختلف تولید می شود.کربنات سدیم سنگین یکی از کالاهای مورد استفاده و مهم است که به طور عمده به تولید ناخالص داخلی کمک می کند. کربنات سدیم سنگین در سه درجه اصلی - سبک، متوسط و متراکم ساخته شده است. این خواص شیمیایی کربنات سدیم سنگین مشابه دارند و تنها با ویژگی های فیزیکی، مانند چگالی فشرده و اندازه و شکل ذرات (که بر ویژگی های جریان و زاویه رطوبت تاثیر می گذارد) تفاوت دارند.
کربنات سدیم سنگین در تولید شیشه (55٪)، خمیر کاغذ و کاغذ (5٪)، صابون و بسیاری از مواد شیمیایی دیگر (25٪) مانند سدیم سیلیکات و فسفات سدیم استفاده می شود. همچنین کربنات سدیم سنگین به عنوان عامل قلیایی در صنایع شیمیایی استفاده می شود.
در داخل کشور کربنات سدیم سنگین به عنوان یک نرم کننده کننده آب در طول شستشو استفاده می شود. این با منیزیم یون ها و کلسیم در آب سخت رقابت می کند و مانع از اتصال آنها با مواد شوینده می شود. بدون استفاده از شستن ، برای جذب یونهای منیزیم و کلسیم، مواد شوینده اضافی مورد نیاز است.
کربنات سدیم سنگین نیز در فرایند عکاسی شناخته شده به عنوان reticulation استفاده می شود. یک فیلم منفی را می توان در یک حمام داغ از کربنات سدیم قرار داد که ممکن است نقره فی به آن چسبیده شود و امولسیون را از پایه فیلم جدا سازد و یک تصویر ترک خورده و انتزاعی ایجاد کند.
کربنات سدیم سنگین نیز توسط صنایع آجر به عنوان عامل مرطوب برای کاهش مقدار آب مورد نیاز برای رساندن رس به کار می رود.
کربنات سدیم سنگین محلول در آب است، اما می تواند به طور طبیعی در مناطق خشک، به خصوص در ذخایر معدنی (evaporites) شکل گرفته، زمانی که دریاچه های فصلی تبخیر می شود رخ می دهد. سپرده های نفتی معدنی، ترکیبی از کربنات سدیم و بی کربنات سدیم، از زمان های قدیم از زمین های خشک دریاچه در مصر استخراج شده است، زمانی که از ساختن مومیایی ها و تولید زود هنگام شیشه استفاده شد. کربنات سدیم سنگین دارای سه فرم شناخته شده هیدرات است: دکا هیدرات کربنات سدیم، هپاتاید هیدرات کربنات سدیم و مونوهیدرات سدیم کربنات.
فرآیند Leblanc
در سال 1791، شیمیدان فرانسوی نیکلاس لوبلان فرآیند تولید کربنات سدیم سنگین را از نمک، اسید سولفوریک، سنگ آهک و ذغال سنگ ثبت کرد. اول، نمک دریایی (کلرید سدیم) در اسید سولفوریک برای تولید سولفات سدیم و گاز کلرید سدیم، بر اساس معادله شیمیایی
2 NaCl + H2SO4 Na2SO4 + 2 HCl
سپس سولفات سدیم با سنگ آهک خرد شده (کربنات کلسیم) و زغال سنگ مخلوط شد و مخلوط سوختن، تولید کربنات سدیم همراه با دی اکسید کربن و سولفید کلسیم.
Na2SO4 + CaCO3 + 2C Na2CO3 + 2 CO2 + CaS
كربنات سديم از خاکستر با آب استخراج شد و سپس با آب به تبخير رسيد. هنگامی که شرکت ها روند تولید و تولید خاکستر سودا را تولید می کنند، تعدادی از ترکیبات سدیم دیگر به عنوان محصولات مشترک، از جمله بیکربنات سدیم (همچنین به عنوان سودا سدیم)، سولفیت سدیم، تراتو پلی فسفات سدیم و سدیم شیمیایی سدیم ساخته می شوند. ما اینجا هستیم تا مواد شیمیایی با کیفیت را با قیمت مناسب عرضه کنیم. تمام محصولات ما را می توان در مقیاس به اندازه و به مقدار کامیون خریداری شده است. کربنات سدیم سنگین می توان به: رده کربنات سدیم سنگین برای استفاده در صنعت و رده دوم کربنات سدیم برای استفاده در صنعت، با توجه به استفاده می شود. کربنات سدیم سنگین نور پودر کریستالی سفید است، کربنات سدیم سنگین ذرات ریز سفید است. تمامی سعی ما این است که بتوانیم بهترین پینهاد را به شما مشتریان عزیز ارائه دهیم.
سودا یکی از نام های معمول برای هیدروکسید سدیم (NaOH) است.
همچنین به عنوان لیز شناخته می شود، گرچه لیز ممکن است به هیدروکسید پتاسیم یا هیدروکسید سدیم اشاره کند.
سودا سود سوز برای ساخت شمع یا صابون فروخته می شود.
سود سوزآور نوشیدنی در پاک کننده تخلیه یافت می شود.
از آنجاییکه لیو برای مواد مخدر غیرقانونی استفاده می شود، مقادیر زیادی از مقادیری از گذشته مصرف می شود. با این حال، ظروف کوچک در فروشگاه ها و آنلاین در دسترس هستند.
استفاده از سود سوزآور یا لیزر
لیز برای ساخت صابون، ساخت شمع، بیودیزل خانگی، شیشه ی سرامیک، ساخت چندین غذا و آزمایش های شیمی مورد استفاده قرار می گیرد.
چگونگی دریافت نوشابه یا لعاب سوزنی
خیلی سخت تر از آن است که از گذشته استفاده شود. منبع اصلی نوشابه الکلی Red Devil Lye بود، اما این محصول اکنون از بازار خارج شده است. چرا چاق شدن دشوار است؟ دلیل این است که می توان از آن برای کنترل pH در تولید متامفتامین استفاده کرد. هنوز هم چند راه برای دریافت مواد شیمیایی وجود دارد. اطمینان حاصل کنید که محصول 100٪ هیدروکسید سدیم، چربی یا سود سوز است. این امر مخصوصا در هنگام غذا مهم است، زیرا یک محصول ناخالص ممکن است حاوی آلودگی های خطرناک باشد.
منابع چربی عبارتند از:
تمیز کننده تخلیه کنید (برچسب را بررسی کنید) - به عنوان مثال Cleaner Drain Roybic Crystal Drain که به عنوان Lowes فروخته می شود
هیدروکسید سدیم از فروشگاه آنلاین مواد شیمیایی عرضه
فروشگاه صابون
فروشگاه شمع سازی
فروشگاه عرضه بیودیزل
در هنگام خرید نوشابه یا چای سوزانید، ممکن است لازم باشد یک بیانیه را امضا کنید که از آن برای فعالیتهای غیرقانونی استفاده نکنید. یا ممکن است نیازی به امضای هیچ چیز نداشته باشید، زیرا کارت اعتباری تقریبا تمام جزئیات مورد نیاز برای پیدا کردن شما را در اختیار می گذارد اگر فکر کنند که شما یک پرستار مواد مخدر هستید.
نکات مفید
از آنجا که نسبتا سخت است که این ماده شیمیایی را نگه دارید، ممکن است لازم باشد که به صورت عمده خرید کنید. شما ممکن است قادر به پیدا کردن افراد دیگری باشید که به مواد شیمیایی نیاز دارند تا به هزینه تقسیم شوند. این مورد گران نیست، اما شما احتمالا چندین پوند از آن را نیاز ندارید.
ظرف را بسته بندی کنید و دور از رطوبت نگه دارید. سودا سوزنی جذب می کند و با آب واکنش می دهد.
از بچه ها و حیوانات خانگی جلوگیری کنید. لمس کردن یا خوردن آن می تواند باعث سوختگی شدید شیمیایی شود.
از دستکش و یا ظروف استفاده کنید تا نوشیدنی سودا را اداره کنید.
واکنش های مربوط به این مواد شیمیایی را در یک اتاق تهویه مناسب یا خارج از منزل انجام دهید. واکنش گرما و گازهای مضر را آزاد می کند.
آب Javelle یا آب Javel هر دو: محلول آبی سدیم هیپوکلریت یا پتاسیم. این در ابتدا در نزدیکی شهر فرانسوی Javelle (که در حال حاضر بخشی از پاریس بود) ساخته شد و اولین کلر شیمیایی بود که اولین بار توسط CL Berthollet در سال 1785 نشان داده شد. از طریق عبور گاز کلر از طریق محلول آب پتاس (کربنات پتاسیم) . پس از اختراع پودر سفید کننده، آب جواول بوسیله واکنش پودر سفید کننده با پتاس یا خاکستر سودا (کربنات سدیم) تولید می شود. در حال حاضر معمولا محلول سدیم هیپوکلریت است، آن را در سفید کردن و به عنوان یک ضد عفونی کننده استفاده می شود.
سدیم هیپوکلریت
سدیم هیپوکلریت (NaOCl) ترکیبی است که می تواند به طور موثر برای تصفیه آب مورد استفاده قرار گیرد. این در مقیاس بزرگ برای تمیز کردن سطح، سفید کردن، برداشتن بوی و ضدعفونی آب استفاده می شود.
وقتی سدیم هیپوکلریت کشف شد
سدیم هیپوکلریت دارای سابقه طولانی است. حدود 1785 فرانسوی Berthollet مایع سفید کننده ها را بر اساس سدیم هیپوکلریت تولید کرد. شرکت Javel این محصول را معرفی کرد و آن را "Liqueur de Javel" نامید. در ابتدا، آن را برای سفید کردن پنبه استفاده می شود. به علت ویژگی های خاص آن به زودی یک ترکیب محبوب تبدیل شد. هیپوکلریت می تواند لکه ها را از لباس ها در دمای اتاق حذف کند. در فرانسه، سدیم هیپوکلریت هنوز به عنوان "ادو داویل" شناخته می شود.
خصوصیات سدیم هیپوکلریت چیست؟
سدیم هیپوکلریت یا آب ژاول یک محلول روشن و کمی زرد است که دارای بوی مشخص است.
سدیم هیپوکلریت دارای تراکم نسبی 1،1 (5/5٪ محلول آبی) است.
به عنوان یک ماده سفید کننده برای استفاده خانگی، معمولا حاوی سدیم هیپوکلریت 5٪ (با pH حدود 11، آن را تحریک کننده است). اگر بیشتر متمرکز باشد، حاوی غلظت 10-15٪ سدیم هیپوکلریت (با pH حدود 13، آن را می سوزاند و خورنده است).
سدیم هیپوکلریت ناپایدار است. کلر با میزان 0.75 گرم کلر فعال در روز از محلول تبخیر می کند. سپس سدیم هیپوکلریت تجزیه می شود. این نیز زمانی اتفاق می افتد که سدیم هیپوکلریت در تماس با اسیدها، نور خورشید، فات خاص و گازهای سمی و خورنده، از جمله گاز کلر، اتفاق می افتد. سدیم هیپوکلریت یک اکسید کننده قوی است و با ترکیبات قابل اشتعال و واکنش دهنده ها واکنش نشان می دهد. محلول سدیم هیپوکلریت یک پایه ضعیف است که قابل اشتعال است.
این ویژگی ها باید در حین انتقال، ذخیره و استفاده از سدیم هیپوکلریت در نظر گرفته شود.
اساسا آب (H2O) با مولکول اکسیژن (H2O2) است که در بسیاری از زبانها به عنوان آب اکسیژنه شناخته می شود و به همین دلیل بسیار سازگار با محیط زیست است و به آب و اکسیژن فرو می ریزد. به طور طبیعی در شیر و شیردوشی، آب باران، میوه تازه و بدن انسان وجود دارد. این می تواند به عنوان یک عامل تمیز کننده یا یک ضد عفونی کننده، و همچنین برای برداشتن آبله های دریایی و انگل های آمیب در ماهی آزاد و ماهی های دیگر استفاده شود.
آب آشامیدنی تمیز برای بقای ما حیاتی است. پس از بازیابی آب از زیر زمین، به طور معمول فیلتر شده و اکسید می شود و به طور مستقیم به کاربر نازل می شود. در گیاهان آب شیرین مدرن، آب در لوله های بسته و سیستم های تصفیه مورد استفاده قرار می گیرد، به این معنی است که آب با هوای اطراف ارتباطی ندارد و به همین دلیل تغییرات آلودگی هوا و یا مشابه آنها را کاهش می دهد. با استفاده از سیستم های بسته، اکسیژن خالص 95٪ به آب در سطح 7 ppm در هر لیتر مخلوط می شود و اکسیژن کامل آب را قبل از اینکه به کاربر نهایی پخش شود، مخلوط می کند.
اکسیژن ژنراتورهای اکسیمت برای فاضلاب
درمان و تمیز کردن فاضلاب یک فرایند پیچیده است که اکسیژن نقش مهمی را ایفا می کند. گیاهان گاز طبیعی اکسیژن را برای اوزون و فاضلاب عرضه کنیم. فاضلاب با استفاده از فیلترهای زیستی می تواند درمان شود. فیلترهای زیستی نیاز به اکسیژن خالص برای تبدیل شدن به حداکثر کارایی دارند.
مزایای
بسیار مقرون به صرفه
مصرف انرژی کم است
افزایش اثربخشی حذف آلاینده ها را افزایش می دهد
محیط زیست ایمن
هیدروژن پراکسید مستقر در چشم یا لنزهای تماسی شما می تواند باعث خارش، سوزش و آسیب موقت قرنیه شود. هنگام استفاده از پراکسید هیدروژن، شما باید با استفاده از یک خنثی کننده فرآیند ضد عفونی را دنبال کنید. خنثی کننده پراکسید را به آب و اکسیژن تبدیل می کند و باعث می شود که لنزهایتان را به چشمانتان برسانید.
پلی آلومینیوم کلراید چه نوع ماده ای می باشد
پلی آلومینیوم کلراید، که به آن PAC نیز گفته می شود ، یک عامل جدید ه سازی ماکرومولکول معدنی با کارایی بالا نوع جدید است. پلی آلومینیوم کلراید این پلیمر معدنی است که توسط کلرید آلومینیوم ، هیدروکسید آلومینیوم ، آلومینا یا سایر ترکیبات آلومینیوم معدنی با اسید هیدروکلریک سنتز می شود. پلی آلومینیوم کلراید پلیمری به طور معمول در پالپ و کاغذ ، پارچه ، تصفیه آب و پلاستیک و لاستیک و غیره استفاده می شود.
پلی آلومینیوم کلراید به عنوان یک محصول مهم تصفیه آب ، کلرید پلی آلومینیم به طور گسترده ای در پالپ و کاغذ ، پارچه ، تصفیه آب ، پلاستیک و لاستیک و سایر موارد استفاده می شود. پالپ و کاغذ و منسوجات کاربردهای عمده پلی آلومینیوم کلراید است .برای شناخت ساختار بازار پلی آلومینیوم کلراید (PAC) با شناسایی بخشهای مختلف آن را بدانید.
تمرکز خود را بر روی تولید کنندگان کلیدی جهانی پلی آلومینیوم کلراید (PAC) ، برای تعریف ، توصیف و تجزیه و تحلیل حجم فروش ، ارزش ، سهم بازار ، چشم انداز رقابت در بازار ، تجزیه و تحلیل SWOT و برنامه های توسعه در چند سال آینده می باشد. تصفیه آب یکی از مهمترین کاربردهای نهایی پلی کلرید آلومینیوم (PAC) است. همچنین در صنعت خمیر و کاغذ کاربرد زیادی دارد.
پلی آلومینیوم کلراید کاربرد گسترده ای در تصفیه فاضلاب به دلیل کاهش تولید لجن ، انعقاد موثر در فاضلاب ، پلی آلومینیوم کلراید جایگزینی بهتر برای آلوم و تنظیم pH به حداقل رسیده است. انتظار می رود افزایش آگاهی در مورد آب آشامیدنی سالم و تمیز باعث افزایش تقاضای پلی آلومینیوم کلراید می شود.
علاوه بر این ، نمکهای پلی آلومینیوم کلراید مانند سولفات کلرید آلومینیوم در اندازه کاغذ برای بهبود عملکرد نشاسته و تصفیه آب و پساب در طی پردازش کاغذ استفاده می شود. افزایش تقاضای کاغذ نسبت به پلاستیک را می توان به مصرف پلی آلومینیوم کلراید در صنعت کاغذ و خمیر کاغذ نسبت داد. از آنجا که لجن تولید شده توسط پلی آلومینیوم کلراید نسبت به آلوم جمع و جور است ، صنایع سخت افزاری در هنگام جایگزین کردن آب بسیار سخت است. بنابراین ، افزایش ضایعات صنعتی و کشاورزی استفاده از پلی آلومینیوم کلراید را در تصفیه فاضلاب به وجود آورده است. با این حال ، پلی آلومینیوم کلراید ممکن است با توجه به فاکتور هزینه و زیرساخت ضعیف کارخانه های تصفیه آب در اقتصادهای نوظهور با مشکل روبرو شود.
گزارش در مورد بازار پلی آلومینیوم کلراید توسط تحقیقات بازار آینده شامل تحقیقات اولیه گسترده همراه با تجزیه و تحلیل دقیق از جنبه های کمی و کیفی توسط متخصصان مختلف صنعت و رهبران افکار کلیدی برای به دست آوردن بینش عمیق تر از عملکرد بازار و صنعت پلی آلومینیوم کلراید است. مقررات دولت در مورد آب آشامیدنی و تصفیه فاضلاب صنعتی باعث افزایش تقاضا برای مواد شیمیایی تصفیه آب شده است انتظار می رود که در آینده نزدیک تقاضا برای پلی آلومینیوم کلراید را تحریک کند. علاوه بر این ، کاهش ذخایر آب شیرین نیاز به تصفیه فاضلاب را ایجاد کرده است.
استفاده از سود پرک و داده های بازار
سود پرک (هیدروکسید سدیم) یک قلیایی همه کاره است. مصارف اصلی آن در تولید خمیر و کاغذ ، آلومینا ، صابون و مواد شوینده ، فرآورده های نفتی و تولید مواد شیمیایی است. سایر کاربردها شامل تصفیه آب ، مواد غذایی ، منسوجات ، فرآوری ف ، معدن ، ساخت شیشه و موارد دیگر است. یکی از بزرگترین مصرف کنندگان سود پرک در زمینه صنعت خمیر و کاغذ است که از آن در فرآیندهای خمیر و سفید کننده ، تزریق کاغذهای زباله و تصفیه آب استفاده می شود.
سود پرک یک ماده اولیه اساسی در تولید طیف گسترده ای از مواد شیمیایی است. این ماده به عنوان واسطه و یک ماده واکنش دهنده در فرآیندهای تولیدکننده حلال ، پلاستیک ، الیاف مصنوعی ، سفید کننده ، چسب و داروهای مورد استفاده قرار می گیرد.
هیدروکسید سدیم جامد یا سود پرکممکن است باعث سوختگی شیمیایی ، آسیب دائمی یا زخم و کوری شود. هنگام حل سود پرکدر آب ، واکنش بسیار گرمازا است و گرمای حاصل از آن ممکن است باعث سوختگی گرما یا اشتعال شود. سود پرکبسیار واضح است و در واکنشی که باعث ایجاد نمک می شود با چربی ها و روغن های موجود در پوست واکنش نشان می دهد. به همین دلیل ، هیدروکسید سدیم بسیار خطرناک است و به دنبال تماس با این ماده ، پوست باید کاملاً با آب شسته شود. یک محلول از 0.5M یا بیشتر سود پرکباید برچسب خورده شود ، در حالی که یک محلول بین 0.5-0.05M باید برچسب زده شود.
سود پرکمایع دارای خاصیت فاسد کننده ای بر روی تمام بافت های بدن است. حتی ممکن است سود پرکپس از تماس طولانی مدت بر روی بافت اثر مخرب می گذارند. استنشاق سود پرکمی تواند باعث آسیب در دستگاه تنفسی فوقانی می تواند صدمات شدیدی را به همراه داشته باشد.
غشاهای مخاطی یا سایر بافتهایی که ب سود پرکدر تماس هستند
مهم است كه كسانی كه از سود پرکاستفاده می كنند ، از خواص خورنده آن آگاه باشند.می دانید چه احتیاط هایی را باید انجام دهید. در صورت قرار گرفتن تصادفی در معرض آن ، بلافاصله در آن محدوده را شستشو دهید.
اثرات سلامتی/خطرات ایمنی: این سود پرکقوی و بسیار خورنده است که به راحتی بافت های زنده را تجزیه می کند. تماس پوست با سود پرکمی تواند منجر به سوختگی شدید شیمیایی شود و تماس چشمی می تواند باعث کوری دائمی شود. سود پرکبا واکنش بسیار گرمازا با آب و اسیدها واکنش نشان می دهد و از طریق پاشیدن می تواند باعث سوختگی شود.
سود پرکیکی از نامهای رایج هیدروکسید سدیم (NaOH) است که به آن به عنوان چاودار نیز معروف است. نام مشترک آن از هویت شیمیایی آن به عنوان یک هیدرات سدیم نشات گرفته و به دلیل داشتن سوز آور یا خورنده است. به شکل خالص ، سود پرکیک جامد مومی و سفید است. به راحتی آب را جذب می کند و محلول های آبی را تشکیل می دهد.
سیلیکاژلچیست و چرا بسته های کمی از آن را در هر آنچه خریداری می کنم پیدا می کنیم؟
بسته های کمی از سیلیکاژل در انواع محصولات وجود دارد زیرا سیلیکاژلماده خشک کننده است - جذب و نگه داشتن بخار آب می شود. در محصولات چرمی و غذاهایی مانند فلفلونی ، عدم رطوبت می تواند رشد قالب را محدود کرده و از بین بردن آن را کاهش دهد. در الکترونیک از تراکم جلوگیری می کند ، که ممکن است به الکترونیک آسیب برساند. اگر یک بطری ویتامین حاوی بخار رطوبت باشد و به سرعت خنک شود ، رطوبت چگالش قرص ها را خراب می کند. شما بسته های سیلیکاژلکمی در هر چیزی که تحت تأثیر رطوبت اضافی یا چگالش باشد ، خواهید یافت.

سیلیکاژلتقریبا بی ضرر است ، به همین دلیل آن را در محصولات غذایی پیدا می کنید. سیلیکاژلیا همان دی اکسید سیلی (SiO2) همان ماده ای است که در کوارتز یافت می شود. فرم سیلیکاژلحاوی میلیون ها منافذ ریز است که می تواند رطوبت را جذب و نگه دارد.
یک بسته کاغذی کوچک با دانه های شفاف کوچک که کاملاً در آن پیچیده شده است و آن سیلیکاژلاست. آنها به دلایل زیادی مانند صرفه جویی در محصول از آب ، کاهش بوی بد و مواردی از این دست مفید هستند.
بسته بندی محصول با تفکر جدی در مورد آن انجام می شود زیرا ضروری است تا رسیدن به مشتری همه چیز کامل باشد. به همین دلیل است که بسته بندی محصول سیلیکاژلرا در جعبه تأمین می کند تا از بروز بلایای آن در امان بماند. رطوبت: تنها هدف این دانه های متخلخل کوچک (سیلیکاژل )، جذب مولکول های آب کوچک به سمت خود و قفل شدن رطوبت از سطح بسته است. آنها در کیسه های کاغذی بسته بندی شده اند که اجازه ورود آب را می دهد. این ژل از سیلیکات سدیم ساخته شده است که از نظر طبیعت یا ترکیب بسیار جذب می کند. این سیلیکاژل40٪ از وزن خود را جذب می کند و برخلاف سایر محصولات موجود در بازار ، بسیار جذب مواد می شود.
در حین تولید ، یک محصول مراحل و مواد شیمیایی زیادی را پشت سر می گذارد که می تواند بوی بدی در محصولات باقی بگذارد و هنگامی که مدت زمان طولانی در کارتن های مقوایی بسته بندی می شود می تواند بوی غیرقابل تحمل برود و تأثیر نامطلوبی بر مشتریان بگذارد. این سیلیکاژلبا جذب رطوبت اضافی از هوا در داخل جعبه می توانند از بو دار شدن جلوگیری کنند. سیلیکاژلبیشتر در محصولات مصرفی ، از جعبه کفش گرفته تا کیف پول گرفته تا تلفن همراه جدید یا وسایل غذایی یافت می شوند.
دانه های تغییر رنگ: دانه هایی وجود دارد ، سیلیکاژلموجود در بازار است که هنگام تماس با آب رنگ آن را تغییر می دهد. این باعث می شود راحت بگویید رطوبت هر چه مقدار یا چه مقدار در جعبه وجود دارد. طراحی بسته بندی محصول ضروری است که ساخته شود و هیچ فضای باز یا لبه ای نداشته باشد که می تواند دلیل ورود هوا باشد.
اسید کلریدریکچیست؟
از اسید کلریدریک نیز در تولید باتری ، لامپهای فتفلاش و آتش بازی استفاده می شود. حتی برای پردازش قند و تهیه ژلاتین نیز استفاده می شود. اسید کلریدریک مانند ترکیب کلر ، کلرید سدیم یکی دیگر از مواد شیمیایی است که از طرق مختلفی فوق العاده مفید است.
برخلاف کلرید سدیم ، اسید کلریدریک کار آسانی نیست و اقدامات احتیاطی باید حتماً انجام شود! این اسید بوی تیز و تحریک کننده دارد و بسیار خورنده است به این معنی که بیشتر چیزهایی را که لمس می کند صدمه می زند. شاید تعجب کنید که چگونه می توان چنین مایع واکنش پذیر را بدون خراب کردن ظرف آن ذخیره کرد. ظروف فی برای اسید کلریدریک مناسب است ، اما ظروف پلاستیکی مانند پلاستیک ساخته شده از PVC (پلی وینیل کلرید) خوب نخواهند بود.
موارد مهم و کاربردهای اسید کلریدریک
اسید کلریدریک / اسید موریاتیک یک ترکیب شیمیایی بسیار خورنده است و دارای چندین کاربرد است. در اینجا چند کاربرد اسید کلریدریک وجود دارد:
1. برای تولید ترکیبات آلی
اسید کلریدریک دارای چندین کاربرد صنعتی است و یکی از این کاربردها در تولید ترکیبات آلی مانند دی کلرواتان و وینیل کلرید برای PVC است. همچنین در تولید سایر ترکیبات آلی مانند بیسفنول A نیز مورد استفاده قرار می گیرد که در محصولات دارویی مختلف مورد استفاده قرار می گیرد.
2. برای تولید ترکیبات معدنی
اسید کلریدریک بسیار مورد استفاده قرار می گیرد ، تولید ترکیبات معدنی مانند مواد شیمیایی تصفیه آب مانند کلرید پلی آلومینیوم (PAC) و کلرید آهن (III) است که به عنوان عوامل انعقادی و ه سازی در تولید آب آشامیدنی ، تصفیه فاضلاب و تولید کاغذ مورد استفاده قرار می گیرد. .
3. برای از بین بردن لکه های فی
حذف لکه های فی
اگرچه اسید کلریدریک بسیار خورنده است ، اما برای از بین بردن لکه ها از فات استفاده می شود. اسید کلریدریک می تواند آهن ، مس ، برنج و سایر فات را تمیز کند. اما باید با افزودن 9 قسمت آب به 1 قسمت اسید آن را رقیق کرد. نباید از آن به طور مستقیم بر روی فات استفاده کرد زیرا ماده تمیز کننده ای بسیار قدرتمند است.
4- برای تمیز کردن استخرها
اگرچه استخرها را می توان با مواد شوینده و اسکراب های معمولی تمیز کرد ، اما حذف برخی لکه ها که بین کاشی ها چسبیده اند ، کار ساده ای نیست. در این حالت ، اسید کلریدریک مفید است. در اینجا نیز باید 10 قسمت آب را به 1 قسمت اسید کلریدریک اضافه کنید تا یک محلول برای تمیز کردن استخر تهیه شود.
5- برای هضم غذاها
اسید کلریدریک در معده بدن انسان نیز وجود دارد که به هضم غذاها کمک می کند. محتویات معده را اسیدی می کند.
6- برای خنثی سازی و کنترل pH
اسید کلریدریک برای تنظیم اسیدیته (pH) محلول ها استفاده می شود. برای کنترل pH محصولات دارویی ، غذاها و آب آشامیدنی استفاده می شود. همچنین اسید کلریدریک برای خنثی کردن جریان های زباله (حاوی مواد قلیایی) نیز استفاده می شود.
7. برای تولید نفت
اسید کلریدریک در فرآیند تولید روغن استفاده می شود. هنگامی که اسید کلریدریک به داخل سنگ تزریق می شود ، یک ساختار منافذ بزرگ تشکیل می دهد ، که باعث تحریک تولید روغن می شود.
اسید نیتریک ماده ای است که بیشتر از آنچه فکر می کنیم با آن روبرو می شویم. اگر تاکنون یک کیسه کود خریداری کرده اید یا در باران گرفتار شده اید ، با اسید نیتریک روبرو شده اید. ساخت کود در واقع رایج ترین کاربرد اسید نیتریک است. شاید جالب تر اینکه آب باران به طور طبیعی اسیدی است به این معنی که غلظت کمی از اسید نیتریک موجود در آن وجود دارد.
اسید نیتریک یک ماده اسیدی بسیار خورنده است. حالت بدنی آن یک مایع بی رنگ است ، اما گاهی اوقات ممکن است دارای رنگ مایل به زرد باشد. اسید نیتریک فاتی مانند آهن ، مس و نقره را حل می کند. این ماده اکسید کننده قوی است ، ماده ای که به آسانی الکترون ها را از ماده دیگری پذیرفته است.

استفاده از اسید نیتریک
تاکنون استفاده اصلی از اسید نیتریک (80٪) در تولید کودها است. از این 96٪ برای تهیه نیترات آمونیوم و نیترات آمونیوم کلسیم استفاده می شود. برای ساخت مواد منفجره از مقدار نسبتاً کمی نیترات آمونیوم استفاده می شود.
برخی از اسید نیتریک برای ساخت واسطه ها در صنعت پلیمر بکار می رود ، به ویژه در ساخت اسید هگزانیدوئیک (اسید چربی) برای ساختن پلی آمیدها و TDI (تولوئن دییزوسیانات یا متیل بنزن دییزوسیانات) و دینیتروبنزن دو از طیف وسیعی از معرفها که برای ساختن پلی اورتان ها استفاده می شود.
اسید نیتریک ماده ای بسیار مهم است که به عنوان ماده اولیه برای تولید مواد دیگر استفاده می شود. این امر باعث اهمیت آن در صنایع شیمیایی و دارویی می شود. متداول ترین کاربرد اسید نیتریک تهیه کود است. یکی از مواد اولیه مورد نیاز برای تهیه یک کود مؤثر ، اسید نیتریک است ، در جایی که برای تولید نیترات آمونیوم با آمونیاک واکنش نشان می دهد.
موارد استفاده از اسید نیتریک: مهندسی هوافضا
آیا تا به حال فکر کرده اید که چه چیزی به درون پیشرانهای موشکی وارد می شود؟ موشک ها از نوع پیشرانه های مختلف استفاده می شوند. در موشک های با مایع ، یک اکسید کننده مایع با سوخت ترکیب می شود. اسید نیتریک به عنوان یک ماده اکسید کننده قوی ، به عنوان اکسید کننده در موشک های با مایع مورد استفاده قرار گرفته است.
از اسید نیتریک نیز به عنوان پیش ماده سازنده ترکیبات حاوی نیتروژن آلی مانند نایلون استفاده می شود.
از اسید نیتریک نیز برای ساخت نمک نیترات مانند نیترات آمونیوم ، نیترات نقره و نیترات کلسیم استفاده می شود.
استفاده در زندگی روزمره
بیشترین کاربرد اسید نیتریک در مدارس یافت می شود که اغلب از آن به عنوان یک معرف آزمایشگاهی استفاده می شود. از اسید نیتریک رقیق شده برای ساخت چوب استفاده می شود. همچنین در صنایع غذایی کاربرد دارد و به تمیز کردن مواد غذایی و تجهیزات و غیره کمک می کند.
توصیه های ذخیره سازی ( HNO3):
با وجود تمام اسیدها ، غلظت محلول اغلب محدودیت محلولهای ذخیره سازی را تعیین می کند. هرچه غلظت قوی تر باشد ، باید نسبت به مواد شیمیایی نیز دقت بیشتری داشته باشید.
درباره این سایت